【抓重点】医疗器械俄罗斯RZN注册要求及最新消息
俄罗斯医械市场
俄罗斯的医疗设备市场在近年来稳步增长,预计到2025年,其市场规模将达到约140亿美元。该国医疗设备市场的增长主要得益于人口老龄化和不断增长的医疗需求,以及政府逐步增加对医疗设备的投入。目前,俄罗斯医疗设备市场上的主要产品包括磁共振成像(MRI)设备、超声诊断设备、CT扫描设备、血糖监测设备、呼吸机、心脏起博器等。
近年来,俄罗斯医疗市场高度依赖进口,随着中俄双边经济合作的不断深入,国产产品质量和服务得到了俄罗斯市场的认可,俄罗斯与中国医疗企业合作不断加强。特别是俄乌战争以来,俄罗斯医械市场由于受到多方制裁,医疗器械可能会出现多类产品短缺的情况。那,医疗器械产品出口俄罗斯需要怎么样的准入要求呢?
俄罗斯对医疗器械的注册管理实行强制性的监管,主要由俄罗斯联邦监督局联邦卫生监督局Roszdravnadzor(RZN)负责医疗器械注册分为注册证和注册声明两种类型。
01 注册证
注册证是对高风险医疗器械、中高风险医疗器械和某些低风险医疗器械进行强制性审核注册的程序,获得注册证后才允许在俄罗斯销售和使用。注册所需的文件包括医疗器械设计、技术文件、产品标签和说明书、产品生产资质和临床测试报告等文件。注册声明适用于低风险医疗器械,并且不需要获得俄罗斯注册证。但是,申请人需要提交合法证明文件,并确保产品符合相关俄罗斯标准和法规。
02注册声明
医疗器械注册程序相对复杂,需要由在俄罗斯的注册代理或经销商协助,建议提交注册申请前充分了解相关条款和要求。
一、俄罗斯器械分类
下面是俄罗斯医疗器械认证注册的四个医疗器械风险等级,及其对应的医疗器械类型:
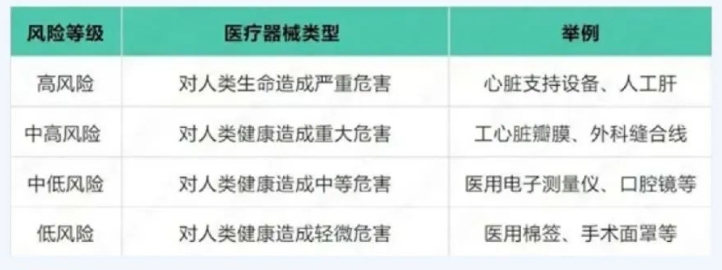
二、俄罗斯器械注册流程
1.确定医疗器械的分类和等级;
2.提交认证注册申请,递交风险分析文件、技术文件和测试报告等相关资料;
3.由俄罗斯认证机构进行初步审核,包括样品检测和生产现场检查;
4.获得注册证书,其中包括医疗器械的技术参数、认证标准、注册证书号码等信息;
5.在注册证书有效期内,需进行年度检查和报告更新等工作。
具体而言,医疗器械认证注册的详细流程可能因不同产品和因不同认证机构而有所不同。企业在进行医疗器械认证注册时务必遵循相关法规和流程,确保产品符合要求并获得认证证书。
三、俄罗斯器械注册周期
俄罗斯国家标准对于医疗器械认证注册的时间没有明确规定,审核周期的长短取决于各个审核机构的工作效率和申请企业提交的文件的完整性和准确性。通常情况下,医疗器械认证注册的周期需要3-6个月不等,具体时间也可能因不同类型和复杂程度的医疗器械、俄罗斯认证机构的工作效率以及审核流程而有所不同。在审核期间,审核机构会开展现场检查、样品检测、技术文件评审等活动。如果该机构发现文件不全或不符合要求,则需要申请者和生产商在规定的期限内进行整改和修正,该过程可能会增加认证的时间。因此,企业在准备医疗器械认证注册前,应提前安排时间,与认证机构和相关合作方积极沟通,通过专业的咨询机构或人员的指导,完善资料、整改缺陷,确保提交的文件完整准确,在最短时间内获得认证证书。
四、俄罗斯进口管制范围
1.认证要求:所有进口医疗器械必须经过俄罗斯医疗器械注册认证,获得认证证书并记录在俄罗斯国家医疗器械注册目录中。
2.关税:俄罗斯对进口的医疗器械征收关税。税收标准由路径和计算公式决定,具体收取标准会根据不同的产品、数量、进口来源等而异。
3.品质管制:进口医疗器械必须符合俄罗斯标准和法规,包括规格、重量、标识、包装等要求。
4.准入要求:需要取得俄罗斯医疗器械进口许可证后才能进行进口。如果进口商和生产商为同一家公司,那么该公司也需要申请特殊许可证,并支付相应费用。
需要注意的是,针对不同的产品,可能还会有特定的管制措施。例如,针对某些较为危险或有争议的医疗器械,俄罗斯可能会对其进口实施额外的管制措施,例如限制数量或要求特定进口管制手续等。企业在进行医疗器械进口前,建议首先了解具体的管控要求和流程,以确保进口合法和顺利。
最新消息:
联邦卫生监督局Roszdravnadzor(RZN)为避免影响器械的正常使用,批准了一份文件清单,该清单旨在确认医疗器械技术和操作文件中未包含的部件(非原装部件)的安全使用。
在2023年5月16日发布的第2983号令中规定了文件的内容要求,包括一份使用非原装部件可能性结论的表格。
制造商要获得许可,必须提供以下资料:
提交申请,提供有关非原装部件的信息,包括所进行的风险分析和测试的文件;
可以共享的产品的信息;
原装部件的信息。
文件中应附有:安装和拆卸手册、清单或规格说明、产品照片、确认能够进行测试的担保信、医疗设备的效能、性能特征和参数。
此外,该指令还包含了有关医疗器械非原装部件的信息列表。有关它们的数据已经发布在俄罗斯联邦医学研究所FGBU VNIIIMT的官方网站上。